Учебника. Несмотря на то, что тРНК значительно мельче, рассказ о ее строении, особенностях и функционировании заслуживает отдельной главы.
Итак, тРНК является «адаптером», который одним своим концом распознает трехбуквенную последовательность генетического кода, сопоставляя ей единственную соответствующую аминокислоту, закрепленную на другом конце тРНК. На прикасающемся к матричной РНК конце транспортной РНК находятся 3 нуклеотида, образующие антикодон . Только в случае комплементарности антикодона к участку мРНК транспортная РНК может к ней присоединиться. Но даже в этом случае тРНК не может присоединиться к мРНК самостоятельно, ей необходима помощь рибосомы, которая является местом их взаимодействия, а также активным участником трансляции. Например, именно рибосома создает связи между принесенными тРНК аминокислотами, формируя протеиновую цепочку.
Особенности строения тРНК обусловлены генетическим кодом, то есть правилами построения протеина по гену, которые транспортная РНК прочитывает. Этот код работает в каждом из живущих на Земле существ: создание вируса записано теми же трехбуквенными кодонами, которые используются для записи «инструкции по сборке» дельфина. Экспериментально проверено, что гены одного живого существа, помещенные в клетку другого, отлично копируются и транслируются в протеины, не отличимые от воспроизводящихся в клетках хозяина генов. На единообразии генетического кода основано производство колониями модифицированных кишечных палочек инсулина и многих других человеческих ферментов, использующихся в качестве лекарств для людей, чей организм не способен их вырабатывать, или вырабатывает недостаточно. Несмотря на очевидную разницу между человеком и кишечной палочкой, протеины человека легко создаются по его чертежам с помощью копировального аппарата кишечной палочки. Неудивительно, что транспортные РНК разных существ отличаются весьма незначительно.

Каждый кодон из этого списка, за исключением трех стоп-кодонов , дающих сигнал о завершении трансляции, должен распознаваться транспортной РНК. Узнавание осуществляется с помощью присоединения к матричной РНК антикодона, который может связаться только с одним кодоном из списка, поэтому тРНК может распознать только один кодон. А значит, в клетке существует как минимум 61 вид этих молекул. На самом деле их даже больше, так как в некоторых ситуациях для считывания матричной РНК недостаточно просто иметь нужный антикодон: требуется выполнение других условий, в соответствии с которыми создается особая, модифицированная тРНК.
На первый взгляд, такое разнообразие тРНК должно существенно осложнять процесс трансляции: ведь каждая из этих молекул будет проверять подставленный ей рибосомой кодон матричной РНК на соответствие своему антикодону — казалось бы, столько бессмысленной механической работы, столько впустую затраченного времени и энергии. Но в результате эволюции сформировались также и клеточные механизмы, предотвращающие эту проблему. Например, количество тРНК каждого вида в клетке соответствует тому, как часто аминокислота, несомая этим видом, встречается в строящихся протеинах. Есть аминокислоты, которые редко используются клеткой, а есть часто использующиеся, и если бы количество несущих их тРНК было одинаковым, это значительно осложнило бы сборку протеинов. Поэтому «редких» аминокислот и соответствующих им тРНК в клетке мало, а часто встречающиеся производятся в большом количестве.

При таком разнообразии молекул тРНК все они очень похожи, поэтому рассматривая их строение и функции, в основном мы будем изучать общие для всех видов черты. Если взглянуть на трехмерную схему тРНК, она кажется плотным нагромождением атомов. Кажется невероятным, что эта сложнозакрученная молекула получена в результате сворачивания длинной цепи нуклеотидов, но именно так она и образуется.
Можно проследить этапы ее образования, начиная с самого первого: составления РНК-полимеразой последовательности нуклеотидов в соответствии с геном, содержащим информацию о данной транспортной РНК. Порядок следования друг за другом этих нуклеотидов и их количество называется первичной структурой тРНК . Получается, что именно первичная структура тРНК закодирована в гене, прочитываемом РНК-полимеразой. Вообще первичной структурой называют последовательность сравнительно простых молекул одного типа, из которых составлена более сложная, свернутая молекула-полимер. Например, первичной структурой молекулы протеина является простая последовательность составляющих ее аминокислот.

Любая цепочка нуклеотидов не может находиться в клетке в развернутом состоянии, просто вытянувшись в линию. На краях нуклеотидов находится слишком много положительно и отрицательно заряженных частей, которые легко образуют водородные связи друг с другом. Про то, как такие же связи образуются между нуклеотидами двух молекул ДНК, соединяя их в двойную спираль, рассказано в , а за подробностями о водородных связях можно залезть в . Водородные связи менее прочны, чем связи между атомами в молекулах, но их достаточно для того, чтобы причудливо скрутить нить тРНК и держать ее в таком положении. Сначала эти связи образуются только между некоторыми нуклеотидами, сворачивая тРНК в фигуру наподобие листа клевера. Результат этого начального свертывания называют вторичной структурой тРНК . На схеме слева видно, что только некоторые нуклеотиды связываются водородными связями, а другие остаются неспаренными, образуя кольца и петли. Различия между вторичной структурой разных видов тРНК обусловлены различиями в их первичной структуре. Проявляется это в разной длине «клеверных листов» или «стебелька» за счет разной длины исходной цепочки нуклеотидов.
Другим отличием первичной структуры разных тРНК является то, что только в некоторых позициях у них стоят одни и те же нуклеотиды (на схеме вверху они отмечены первыми буквами своих названий), большинство же нуклеотидов у разных тРНК отличаются друг от друга. Приведенная выше схема является общей для всех тРНК, поэтому отличающиеся нуклеотиды отмечены числами.
Главными функциональными частями тРНК являются:
=) антикодон , то есть последовательность нуклеотидов, комплементарная единственному кодону матричной РНК, находящаяся на антикодоновой шпильке
=) акцепторный конец , к которому может быть присоединена аминокислота. Он находится с противоположной стороны от антикодоновой шпильки.
В реальности ни одна тРНК не выглядит так, как на схеме вторичной структуры, потому что для ее образования соединились между собой только некоторые нуклеотиды, а остальные остались неспаренными. За счет образования водородных связей между нуклеотидами из разных частей листа клевера он сворачивается дальше в гораздо более сложную третичную структуру в форме буквы L. Ты можешь понять, как именно изогнулись разные части вторичной структуры для образования третичной, сопоставив цвета на их схемах ниже. Антикодоновая шпилька, обозначенная голубым и серым цветами, остается внизу (стоит помнить, что это «внизу» является условным: удобно изображать тРНК именно в такой пространственной ориентации в схемах трансляции белка), а акцепторный конец (желтого цвета) загнут в сторону.

Именно так выглядит тРНК, готовая к присоединению аминокислоты. Самостоятельно соединиться с аминокислотой тРНК не способна, для этого требуется участие специального фермента: аминоацил-тРНК-синтетазы . Число видов синтетаз в клетке совпадает с числом видов тРНК.
Единообразие формы всех видов тРНК необходимо для того, чтобы рибосома могла распознавать любую из них, способствовать их стыковке с мРНК, перемещать внутри себя из одного сайта в другой. Если бы разные виды тРНК существенно отличались друг от друга, это чрезвычайно затруднило бы работу рибосомы, критически снизив скорость синтеза протеина. Естественный отбор таким образом направлен на то, чтобы сделать тРНК похожими друг на друга. Но вместе с тем есть и другой фактор, требующий существования заметных различий между разными видами тРНК: ведь необходимо распознать каждый вид и прикрепить к нему единственную, соответствующую ему аминокислоту. Очевидно, что эти отличия должны быть хоть и заметными, но не слишком существенными, так что работа по распознаванию видов тРНК превращается в ювелирный процесс. И именно его осуществляют аминоацил-тРНК-синтетазы: каждая из них может связаться только с одной из 20 аминокислот и присоединить ее именно к тем видам тРНК, которые этой аминокислоте соответствуют. Из таблицы с генетическим кодом видно, что каждая аминокислота кодируется несколькими последовательностями нуклеотидов, поэтому например все четыре тРНК с антикодонами CGA, CGG, CGU и CGC будут распознаваться одной и той же синтетазой, присоединяющей к ним аланин. Такие обрабатываемые одной синтетазой тРНК называются родственными .
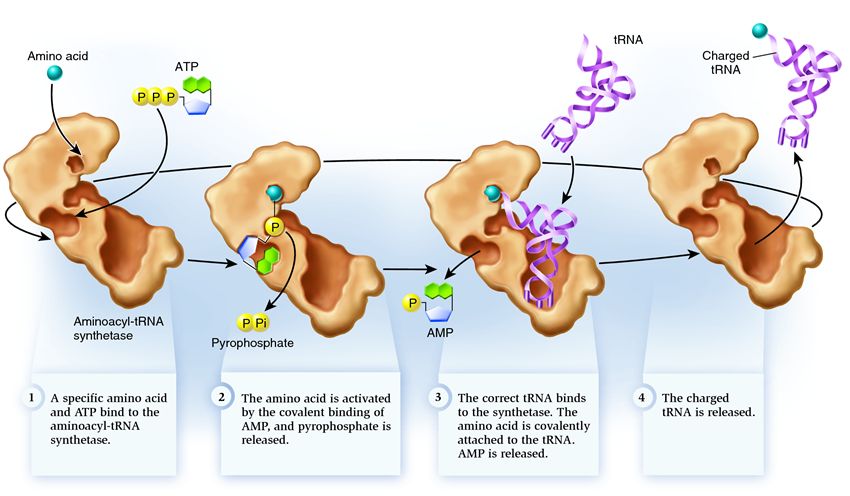
Синтетаза принадлежит к группе ферментов, чья функция заключается в связывании с отдельно существующими молекулами и объединении их в одну:
1 . синтетаза соединяет аминокислоту и молекулу АТФ. От АТФ отрываются две фосфатные группы, высвобождая энергию, необходимую для следующих действий. Остающийся от разрушенной молекулы аденозинмонофосфат (АМФ) присоединяется к аминокислоте, подготовив ее к соединению с акцепторной шпилькой.
2 . синтетаза присоединяет к себе одну из соответствующих этой аминокислоте родственных тРНК.

На этом этапе происходит проверка соответствия транспортной РНК синтетазе. Существует несколько способов распознавания, и в каждой синтетазе имеется уникальная их комбинация. Во взаимодействии синтетазы и тРНК участвует как минимум один нуклеотид антикодона. Так же требует проверки акцепторная шпилька: определяется наличие на ней специфических нуклеотидов, общих для соответствующих нужной аминокислоте родственных тРНК. Нуклеотиды других частей тРНК тоже могут участвовать в проверке соответствия, соединяясь с определенными местами синтетазы. Неправильная тРНК может совпадать с нужной по каким-то параметрам, но из-за неполного совпадения будет присоединяться к синтетазе медленно и неплотно, легко отваливаясь. А правильная тРНК прилипнет к синтетазе быстро и крепко, в результате чего структура синтетазы меняется, запуская процесс аминоацилирования , то есть присоединения аминокислоты к тРНК.

3 . аминоацилирование заключается в замене присоединенной к аминокислоте молекулы АМФ на молекулу тРНК. После этой замены АМФ покидает синтетазу, а тРНК задерживается для последней проверки аминокислоты. Если присоединенная аминокислота опознается как неправильная, она будет отсоединена от тРНК, место аминокислоты в синтетазе опустеет, и туда сможет присоединиться другая молекула. Новая аминокислота пройдет стадии соединения с АТФ и тРНК, и тоже подвергнется проверке. Если же ошибок допущено не было, заряженная аминокислотой тРНК освобождается: она готова сыграть свою роль в трансляции протеина. А синтетаза готова присоединить новые аминокислоту и тРНК, и цикл начнется заново.
От правильности работы аминоацил-тРНК-синтетазы зависит многое: если на этом этапе произойдет сбой, то к тРНК будет присоединена неверная аминокислота. И она будет встроена в растущий на рибосоме протеин, ведь тРНК и рибосома не имеют функции проверки соответствия кодона и аминокислоты. Последствия ошибки могут быть незначительными или катастрофическими, и в ходе естественного отбора существа с ферментами, не имеющими функции таких проверок, были вытеснены более приспособленными, имеющими различные варианты установления соответствия между аминокислотой и тРНК. Поэтому в современных клетках синтетаза соединяется с неверной аминокислотой в среднем в одном случае из 50 тысяч, а с ошибочной тРНК всего лишь один раз на 100 тысяч присоединений.

Некоторые аминокислоты отличаются друг от друга всего лишь несколькими атомами. Если взглянуть на их схемы, становится очевидно, что вероятность перепутать аргинин с аланином гораздо меньше, чем принять изолейцин за лейцин или валин. Поэтому у каждой синтетазы, связывающейся с одной из похожих друг на друга аминокислот, имеются дополнительные механизмы проверки. Вот пример такого приспособления у изолейцин-тРНК-синтетазы:

У каждой синтетазы существует синтетический центр , в котором происходит присоединение аминокислоты к тРНК. Акцепторная шпилька тРНК, захваченной синтетазой, попадает именно туда, так же как и аминокислота, готовая вступить в реакцию с ней. Работа некоторых синтетаз заканчивается сразу после соединения аминокислоты и тРНК. Но Ile-тРНК-синтетаза имеет повышенную вероятность совершения ошибок из-за существования других похожих на изолейцин аминокислот. Поэтому у нее есть еще и коррекционный центр : из названия понятно, какую роль он играет в процессе соединения тРНК и аминокислоты. На рисунке справа видно, что положение конца акцепторной шпильки тРНК в синтетическом центре Ile-тРНК-синтетазы придает этой шпильке неестественный изгиб. Тем не менее, синтетаза удерживает тРНК в таком положении до момента присоединения к ней аминокислоты. После того, как это соединение произошло, необходимость нахождения акцепторной шпильки в синтетическом центре исчерпана, и тРНК распрямляется, попадая своим концом с насаженной на него аминокислотой в коррекционный центр.

Конечно же, синтетический центр тоже играет свою роль в отсеивании не подходящих синтетазе аминокислот. Чтобы попасть в него, молекуле необходимо отвечать ряду условий, в том числе иметь подходящий размер. Несмотря на то, что лейцин и изолейцин содержат одно и то же количество атомов, из-за различий в пространственной структуре лейцин крупнее. Поэтому он не может проникнуть в синтетический центр, размеры которого соответствуют более компактному изолейцину, и просто отскакивает от Ile-тРНК-синтетазы.
Но вот валин, являющийся самой мелкой из этих трех молекул со схожей атомной структурой, легко занимает место изолейцина в синтетическом центре, и синтетаза присоединяет его к тРНК. Именно в этом случае вступает в игру коррекционный центр синтетазы. Если распрямляющаяся акцепторная шпилька заряжена верно и несет изолейцин, то она не может протиснуться внутрь коррекционного центра: он просто слишком мал для этой молекулы. Таким образом, распрямившуюся тРНК больше ничто не держит, и она отсоединяется от синтетазы. А вот если к тРНК присоединен валин, он проскальзывает в коррекционный центр, тем самым удерживая соединенную с ним тРНК в синтетазе. Такое излишне длительное нахождение тРНК внутри является для синтетазы сигналом ошибки, меняя ее пространственную конфигурацию. В результате этого:
=) валин отсоединяется от тРНК и удаляется из синтетазы
=) акцепторная шпилька возвращается в синтетический центр, ожидая присоединения к аминокислоте
=) синтетаза связывается с новой аминокислотой, «заряжает» ей тРНК и снова проверяет, был ли использован для этого именно изолейцин.
Схожий механизм двойного распознавания используется и другими синтетазами.
Различные виды ДНК и РНК – нуклеиновых кислот – это один из объектов изучения молекулярной биологии. Одним из наиболее многообещающих и быстро развивающихся направлений в этой науке в последние годы стало исследование РНК.
Кратко о строении РНК
Итак, РНК, рибонуклеиновая кислота, – это биополимер, молекула которого представляет собой цепочку, образованную четырьмя видами нуклеотидов. Каждый нуклеотид, в свою очередь, состоит из азотистого основания (аденина А, гуанина Г, урацила У либо цитозина Ц) в соединении с сахаром рибозой и остатком фосфорной кислоты. Фосфатные остатки, соединяясь с рибозами соседних нуклеотидов, «сшивают» составные блоки РНК в макромолекулу – полинуклеотид. Так образуется первичная структура РНК.
Вторичная структура – образование двойной цепочки – образуется на некоторых участках молекулы в соответствии с принципом комплементарности азотистых оснований: аденин образует пару с урацилом посредством двойной, а гуанин с цитозином - тройной водородной связи.
В рабочей форме молекула РНК образует также третичную структуру – особое пространственное строение, конформацию.
Синтез РНК
Все виды РНК синтезируются при помощи фермента РНК-полимеразы. Она может быть ДНК- и РНК-зависимой, то есть катализировать синтез как на ДНК, так и на РНК-матрице.
Синтез основан на комплементарности оснований и антипараллельности направления чтения генетического кода и протекает в несколько этапов.
Сначала происходит узнавание и связывание РНК-полимеразы с особой последовательностью нуклеотидов на ДНК – промотором, после чего двойная спираль ДНК раскручивается на небольшом участке и начинается сборка молекулы РНК над одной из цепочек, называемой матричной (другая цепочка ДНК называется кодирующей – именно ее копией является синтезируемая РНК). Асимметричность промотора определяет, какая из цепочек ДНК будет служить матрицей, и тем самым позволяет РНК-полимеразе инициировать синтез в правильном направлении.
Следующий этап называется элонгацией. Транскрипционный комплекс, включающий РНК-полимеразу и расплетенный участок с гибридом ДНК-РНК, начинает движение. По мере этого перемещения наращиваемая цепочка РНК постепенно отделяется, а двойная спираль ДНК расплетается перед комплексом и восстанавливается за ним.

Завершающий этап синтеза наступает, когда РНК-полимераза достигает особого участка матрицы, называемого терминатором. Терминация (окончание) процесса может достигаться различными способами.
Основные виды РНК и их функции в клетке
Они следующие:
- Матричная или информационная (мРНК). Посредством ее осуществляется транскрипция – перенос генетической информации с ДНК.
- Рибосомная (рРНК), обеспечивающая процесс трансляции – синтез белка на матрице мРНК.
- Транспортная (тРНК). Производит узнавание и транспортировку аминокислоты на рибосому, где происходит синтез белка, а также принимает участие в трансляции.
- Малые РНК – обширный класс молекул небольшой длины, осуществляющих разнообразные функции в ходе процессов транскрипции, созревания РНК, трансляции.
- РНК-геномы – кодирующие последовательности, которые содержат генетическую информацию у некоторых вирусов и вироидов.
В 1980-х годах была открыта каталитическая активность РНК. Молекулы, обладающие этим свойством, получили название рибозимов. Естественных рибозимов пока известно не так много, каталитическая способность их ниже, чем у белков, однако в клетке они выполняют исключительно важные функции. В настоящее время ведутся успешные работы по синтезу рибозимов, имеющие в том числе и прикладное значение.
Остановимся подробнее на различных видах молекул РНК.
Матричная (информационная) РНК
Эта молекула синтезируется над расплетенным участком ДНК, копируя таким образом ген, кодирующий тот или иной белок.
РНК эукариотических клеток, прежде чем стать, в свою очередь, матрицей для синтеза белка, должны созреть, то есть пройти через комплекс различных модификаций – процессинг.
Прежде всего, еще на стадии транскрипции, молекула подвергается кэпированию: к ее концу присоединяется особая структура из одного или нескольких модифицированных нуклеотидов – кэп. Он играет важную роль во многих последующих процессах и повышает стабильность мРНК. К другому концу первичного транскрипта присоединяется так называемый поли(А)хвост – последовательность адениновых нуклеотидов.
После этого пре-мРНК подвергается сплайсингу. Это удаление из молекулы некодирующих участков – интронов, которых много в ДНК эукариот. Далее происходит процедура редактирования мРНК, при которой химически модифицируется ее состав, а также метилирование, после чего зрелая мРНК покидает клеточное ядро.

Рибосомная РНК
Основу рибосомы – комплекса, обеспечивающего белковый синтез, составляют две длинные рРНК, которые образуют субчастицы рибосомы. Синтезируются они совместно в виде одной пре-рРНК, которая затем в ходе процессинга разделяется. В большую субчастицу входит также низкомолекулярная рРНК, синтезируемая с отдельного гена. Рибосомные РНК обладают плотно упакованной третичной структурой, которая служит каркасом для белков, присутствующих в рибосоме и выполняющих вспомогательные функции.
В нерабочей фазе субъединицы рибосомы разделены; при инициации трансляционного процесса рРНК малой субчастицы соединяется с матричной РНК, после чего происходит полное объединение элементов рибосомы. При взаимодействии РНК малой субчастицы с мРНК последняя как бы протягивается через рибосому (что равнозначно движению рибосомы по мРНК). Рибосомная РНК большой субчастицы является рибозимом, то есть обладает ферментными свойствами. Она катализирует образование пептидных связей между аминокислотами в ходе синтеза белка.

Следует отметить, что наибольшая часть всей РНК в клетке приходится на долю рибосомной – 70-80 %. ДНК обладает большим количеством генов, кодирующих рРНК, что обеспечивает весьма интенсивную ее транскрипцию.
Транспортная РНК
Эта молекула распознается определенной аминокислотой при помощи особого фермента и, соединяясь с ней, производит транспортировку аминокислоты на рибосому, где служит посредником в процессе трансляции – синтеза белка. Перенос осуществляется путем диффузии в цитоплазме клетки.
Вновь синтезированные молекулы тРНК, так же как и другие виды РНК, подвергаются процессингу. Зрелая тРНК в активной форме имеет конформацию, напоминающую клеверный лист. На «черешке» листа – акцепторном участке – расположена последовательность ЦЦА с гидроксильной группой, которая связывается с аминокислотой. На противоположном конце «листа» находится антикодоновая петля, которая соединяется с комплементарным кодоном на мРНК. D-петля служит для связывания транспортной РНК с ферментом при взаимодействии с аминокислотой, а Т-петля – для связывания с большой субчастицей рибосомы.

Малые РНК
Эти виды РНК играют важную роль в клеточных процессах и сейчас активно изучаются.
Так, например, малые ядерные РНК в клетках эукариот участвуют в сплайсинге мРНК и, возможно, обладают каталитическими свойствами наряду с белками сплайсосом. Малые ядрышковые РНК участвуют в процессинге рибосомной и транспортной РНК.
Малые интерферирующие и микроРНК являются важнейшими элементами системы регуляции экспрессии генов, необходимой клетке для контроля собственной структуры и жизнедеятельности. Эта система – важная часть иммунного антивирусного ответа клетки.
Существует также класс малых РНК, функционирующих в комплексе с белками Piwi. Эти комплексы играют огромную роль в развитии клеток зародышевой линии, в сперматогенезе и в подавлении мобильных генетических элементов.
РНК-геном
Молекула РНК может использоваться в качестве генома большинством вирусов. Вирусные геномы бывают различными – одно- и двухцепочечными, кольцевыми или линейными. Также РНК-геномы вирусов часто бывают сегментированы и в целом короче, чем ДНК-содержащие геномы.
Существует семейство вирусов, генетическая информация которых, закодированная в РНК, после инфицирования клетки путем обратной транскрипции переписывается на ДНК, которая затем внедряется в геном клетки-жертвы. Это так называемые ретровирусы. К ним, в частности, относится вирус иммунодефицита человека.

Значение исследования РНК в современной науке
Если прежде преобладало мнение о второстепенной роли РНК, то ныне ясно, что она - необходимый и важнейший элемент внутриклеточной жизнедеятельности. Множество процессов первостепенной значимости не обходятся без активного участия РНК. Механизмы таких процессов долгое время оставались неизвестными, но благодаря исследованию различных видов РНК и их функций постепенно проясняются многие детали.
Не исключено, что РНК сыграла решающую роль в возникновении и становлении жизни на заре истории Земли. Результаты недавних исследований говорят в пользу этой гипотезы, свидетельствуя о необычайной древности многих механизмов функционирования клетки с участием тех или иных видов РНК. Например, недавно открытые рибопереключатели в составе мРНК (система безбелковой регуляции активности генов на стадии транскрипции), по мнению многих исследователей, являются отголосками эпохи, когда примитивная жизнь строилась на основе РНК, без участия ДНК и белков. Также весьма древним компонентом системы регуляции считаются микроРНК. Особенности структуры каталитически активной рРНК свидетельствуют о ее постепенной эволюции путем присоединения новых фрагментов к древней проторибосоме.
Тщательное изучение того, какие виды РНК и каким образом заняты в тех или иных процессах, исключительно важно также для теоретических и прикладных областей медицины.
Транспортная РНК, тРНК -рибонуклеиновая кислота, функцией которой является транспортировка АК к месту синтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь - будучи в комплексе с аминокислотой - к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса. Для каждой аминокислоты существует своя тРНК. тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». АК ковалентно присоединяется к 3"-концу молекулы с помощью специфичного для каждого типа тРНК фермента аминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий АК-те. тРНК синтезируются обычной РНК-полимеразой в случае прокариот и РНК-полимеразой III в случае эукариот. Транскрипты генов тРНК подвергаются многостадийному процессингу, который приводит к формированию типичной для тРНК пространственной структуры.
Процессинг тРНК включает 5 ключевых этапов:
удаление 5"-лидерной нуклеотидной последовательности;
удаление 3"-концевой последовательности;
добавление последовательности CCA на 3"-конец;
вырезание интронов (у эукариот и архей);
модификации отдельных нуклеотидов.
Транспорт тРНК осущ-ся по Ran-зависимому пути при участии транспортного фактора экспортина t, кот.распознаёт характерную вторичную и третич.стр-ру зрелой тРНК: короткие двуспиральные участки и правильно процессированные 5"- и 3"-концы. Такой механизм обеспечивает экспорт из ядра только зрелых тРНК.
62. Трансляция – узнавание кодона мРНК
Трансляция – это осуществляемый рибосомами синтез белка из аминокислот на матрице мРНК (или и РНК). Cоставляющие элементы процесса трансляции: аминокислоты, тРНК, рибосомы, мРНК, ферменты для аминоацилирования тРНК, белковые факторы трансляции (белковые факторы инициации, элонгации, терминации - специфические внерибосомные белки, необходимые для процессов трансляции), источники энергии АТФ и ГТФ, ионы магния (стабилизируют структуру рибосом). В синтезе белка участвует 20 аминокислот. Чтобы аминокислота «узнала» свое место в будущей полипепетидной цепи, она должна связаться с транспортной РНК (тРНК), выполняющей адапторную функцию. Затем тРНК, связавшаяся с аминокислотой «узнает» соответствующий кодон на мРНК. Узнавание кодона мРНК:
Взаимодействие кодон - антикодон основано на принципах комплементарности и антипараллельности:
3’----Ц - Г- А*------5’ Антикодон тРНК
5’-----Г- Ц- У*------3’ Кодон мРНК
Гипотеза качания (wobble) была предложена Ф. Криком:
3′- основание кодона мРНК имеет нестрогое спаривание с 5′- основанием антикодона тРНК: например, У (мРНК) может взаимодействовать с А и Г (тРНК)
Некоторые тРНК могут спариваться с более, чем одним кодоном.
63. Характеристика составляющих элементов процесса трансляции. Трансляция (translatio-перевод)- процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех организмов имеются спец.органеллы-рибосомы - рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты , и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.
Для узнавания АК-т в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только АК глицин).
Прокариотическая рибосома
5S и 23S рРНК 16S рРНК
34 белка 21 белок
Рибосомы прокариот имеют константу седиментации 70S, отчего получили название 70S-частиц. Они построены из двух неодинаковых субчастиц: 30S- и 50S-субъединиц. Каждая субъединица представляет комплекс рРНК и рибосомных белков.
30S-частица содержит одну молекулу 16S-рРНК и в большинстве случаев по одной молекуле белка из более 20 видов (21) . 50S-субъединица состоит из двух молекул рРНК (23S и 5S). В ее состав входят более 30 различных белков (34), также представленных, как правило, одной копией. Большая часть рибосомальных белков выполняет структурную функцию.
Эукариотическая рибосома
5S; 5,8S и 28S рРНК 18S рРНК
не менее 50 белков не менее 33 белков
Рибосома состоит из большой и малой субъединиц. Основу структуры каждой субъединицы составляет сложн образом свернутая рРНК. К каркасу из рРНК прикрепл рибосомн белки.
Коэффициент седиментации полной эукариотической рибосомы составляет около 80 единиц Сведберга (80S), а коэффициент седиментации ее субчастиц составляет 40S и 60S.
Меньшая 40S-субчастица состоит из одной молекулы 18S-рРНК и 30-40 белковых молекул. Большая 60S-субчастица содержит три типа рРНК с коэффициентами седиментации 5S, 5,8S и 28S и 40-50 белков (например, рибосомы гепатоцитов крысы включают 49 белков).
Функциональные участки рибосом
Р – пептидильный участок для пептидил тРНК
А – аминоацильный участок для аминоацил тРНК
Е – участок для выхода тРНК из рибосомы
Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Рибосомы: строение, финкция
Рибосомы являются цитоплазматическими центрами биосинтеза белка. Они состоят из большой и малой субъединиц, различающихся коэффициентами седиментации (скоростью осаждения при центрифугировании), выражаемые в единицах Сведберга – S.
Рибосомы присутствуют в клетках как эукариот, так и прокариот, поскольку выполняют важную функцию в биосинтезе белков. В каждой клетке имеются десятки, сотни тысяч (до нескольких миллионов) этих мелких округлых органоидов. Это округлая рибонуклеопротеиновая частица. Диаметр ее составляет 20-30 нм. Состоит рибосома из большой и малой субъединиц, различающихся коэффициентами седиментации (скоростью осаждения при центрифугировании), выражаемые в единицах Сведберга – S. Эти субъединицы объединяются в присутствии нити м-РНК (матричной, или информационной, РНК). Комплекс из группы рибосом, объединенных одной молекулой м-РНК наподобие нитки бус, называется полисомой . Эти структуры либо свободно расположены в цитоплазме, либо прикреплены к мембранам гранулярной ЭПС (в обоих случаях на них активно протекает синтез белка).
Полисомы гранулярной ЭПС образуют белки, выводимые из клетки и используемые для нужд всего организма (например, пищеварительные ферменты, белки женского грудного молока). Кроме этого, рибосомы присутствуют на внутренней поверхности мембран митохондрий, где также принимают активное участие в синтезе белковых молекул.
Синтез предшественников рРНК и тРНК сходен с синтезом ире-мРНК. Первичный транскрипт рибосомных РНК не содержит интронов, и при действии специфических РНКаз расщепляется с образованием 28S-, 18S- и 5,8S-pPHK; 5S-pPHK синтезируется при участии РНК-полимеразы III.
рРНК и тРНК.
Первичные транскрипты тРНК превращаются в зрелые формы также путем частичного гидролиза.
Все типы РНК участвуют в биосинтезе белков, но их функции в этом процессе различны. Роль матрицы, определяющей первичную структуру белков, выполняют матричные РНК (мРНК).Важное значение для изучения механизмов трансляции имеет использование бесклеточных систем биосинтеза белков. Если инкубировать гомогенаты тканей со смесью аминокислот, из которых хотя бы одна меченая, то по включению метки в белки можно регистрировать биосинтез белков. Первичная структура синтезируемого белка определяется первичной структурой мРНК, добавленной в систему. Если бесклеточная система составлена с глоби-новой мРНК (ее можно выделить из ретикулоцитов), синтезируется глобин (а- и (3-цепи глобина); если с альбуминовой мРНК, выделяемой из гепатоцитов, синтезируется альбумин, и т. д.
14. Значение репликации:
а) процесс является важным молекулярным механизмом, лежащим в основе всех разновидностей деления клеток проэукариот, б) обеспечивает все типы размножения как одноклеточных, так и многоклеточных организмов,
в) поддерживает постоянство клеточного
состава органов, тканей и организма в результате физиологической регенерации
г) обеспечивает длительное существование отдельных индивидуумов;
д) обеспечивает длительное существование видов организмов;
е) процесс способствует точному удвоениюинформации;
ж) в процессе репликации возможны ошибки (мутации) , что может приводить к нарушениям синтеза белков с развитием патологических изменений.
Уникальное свойство молекулы ДНК удваиваться перед делением клетки называется репликацией.
Особые свойства нативной ДНК как носителя наследственной информации:
1) реплицирование – образование новых цепей комплиментарно;
2) самокоррекция – ДНК-полимераза отщепляет ошибочно реплицированные участки (10-6);
3) репарация - восстановление;
Осуществление этих процессов происходит в клетке с участием специальных ферментов.
Как устроена система репарации Эксперименты, позволившие выявить механизмы восстановления и само существование этой способности, проводились с помощью одноклеточных организмов. Но процессы репарации присущи живым клеткам животных и человека. Некоторые люди страдают пигментной ксеродермой. Это заболевание вызвано отсутствием способности клеток ресинтезировать поврежденную ДНК. Ксеродерма передается по наследству. Из чего же состоит репарационная система? Четыре фермента, на которых держится процесс репарации – это ДНК-хеликаза, -экзонуклеаза, -полимераза и -лигаза. Первый из этих соединений способен распознавать повреждения в цепи молекулы дезоксирибонуклеиновой кислоты. Он не только распознает, но и обрезает цепь в нужном месте, чтобы удалить измененный отрезок молекулы. Само устранение осуществляется с помощью ДНК-экзонуклеазы. Далее происходит синтез нового участка молекулы дезоксирибонуклеиновой кислоты из аминокислот с целью полностью заменить поврежденный отрезок. Ну и финальный аккорд этой сложнейшей биологической процедуры совершается с помощью фермента ДНК-лигазы. Он отвечает за прикрепление синтезированного участка к поврежденной молекуле. После того как все четыре фермента сделали свою работу, молекула ДНК полностью обновлена и все повреждения остаются в прошлом. Вот так слаженно работают механизмы внутри живой клетки.
Классификация На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся: Реактивация. Рекомбинационное восстановление. Репарация гетеродуплексов. Эксцизионная репарация. Воссоединение негомологичных концов молекул ДНК. Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
15. Генети́ческий код - это свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Аминокислотная последовательность в молекуле белка зашифрована в виде нуклеотидной последовательности в молекуле ДНК и называется генетическим кодом. Участок молекулы ДНК, ответственный за синтез одного белка, называется геном.
В ДНК используется четыре нуклеотида - аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом - урацилом, который обозначается буквой U (У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.
Для построения белков в природе используется 20 различных аминокислот. Каждый белок представляет собой цепочку или несколько цепочек аминокислот в строго определённой последовательности. Эта последовательность определяет строение белка, а следовательно все его биологические свойства. Набор аминокислот также универсален для почти всех живых организмов.
Реализация генетической информации в живых клетках (то есть синтез белка, кодируемого геном) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза иРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на матрице иРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом. Принятые сокращения, соответствующие аминокислотам и кодонам, изображены на рисунке.
Свойства генетического кода
Триплетность - значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).
Непрерывность - между триплетами нет знаков препинания, то есть информация считывается непрерывно.
Неперекрываемость - один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов. (Не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки).
Однозначность - определённый кодон соответствует только одной аминокислоте. (Свойство не является универсальным. Кодон UGA у Euplotes crassus кодирует две аминокислоты - цистеин и селеноцистеин)
Вырожденность (избыточность) - одной и той же аминокислоте может соответствовать несколько кодонов.
Универсальность - генетический код работает одинаково в организмах разного уровня сложности - от вирусов до человека (на этом основаны методы генной инженерии) (Из этого свойства также есть ряд исключений, см. таблицу в разделе "Вариации стандартного генетического кода" в данной статье).
16.Условия биосинтеза
Для биосинтеза белка необходима генетическая информация молекулы ДНК; информационная РНК - переносчик этой информации из ядра к месту синтеза; рибосомы - органоиды, где происходит собственно синтез белка; набор аминокислот в цитоплазме; транспортные РНК, кодирующие аминокислоты и переносящие их к месту синтеза на рибосомы; АТФ - вещество, обеспечивающее энергией процесс кодирования и биосинтеза.
Этапы
Транскрипция - процесс биосинтеза всех видов РНК на матрице ДНК, который протекает в ядре.
Определенный участок молекулы ДНК деспирализуется, водородные связи между двумя цепочками разрушаются под действием ферментов. На одной цепи ДНК, как на матрице, по принципу комплементарное из нуклеотидов синтезируется РНК-копия. В зависимости от участка ДНК таким образом синтезируются рибосомные, транспортные, информационные РНК.
После синтеза иРНК она выходит из ядра и направляется в цитоплазму к месту синтеза белка на рибосомы.
Трансляция - процесс синтеза полипептидных цепей, осуществляемый на рибосомах, где иРНК является посредником в передаче информации о первичной структуре белка.
Биосинтез белка состоит из ряда реакций.
1. Активирование и кодирование аминокислот. тРНК имеет вид клеверного листа, в центральной петле которого располагается триплет-ный антикодон, соответствующий коду определенной аминокислоты и кодону на иРНК. Каждая аминокислота соединяется с соответствующей тРНК за счет энергии АТФ. Образуется комплекс тРНК-аминокислота, который поступает на рибосомы.
2. Образование комплекса иРНК-рибосома. иРНК в цитоплазме соединяется рибосомами на гранулярной ЭПС.
3. Сборка полипептидной цепи. тРНК с аминокислотами по принципу комплементарности антикодона с кодоном соединяются с иРНК и входят в рибосому. В пептидном центре рибосомы между двумя аминокислотами образуется пептидная связь, а освободившаяся тРНК покидает рибосому. При этом иРНК каждый раз продвигается на один триплет, внося новую тРНК - аминокислоту и вынося из рибосомы освободившуюся тРНК. Весь процесс обеспечивается энергией АТФ. Одна иРНК может соединяться с несколькими рибосомами, образуя полисому, где идет одновременно синтез многих молекул одного белка. Синтез заканчивается, когда на иРНК начинаются бессмысленные кодоны (стоп-коды). Рибосомы отделяются от иРНК, с них снимаются полипептидные цепи. Так как весь процесс синтеза протекает на гранулярной эндо-плазматической сети, то образовавшиеся полипептидные цепи поступают в канальца ЭПС, где приобретают окончательную структуру и превращаются в молекулы белка.
Все реакции синтеза катализируются специальными ферментами с затратой энергии АТФ. Скорость синтеза очень велика и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 15-20 с.
Транспортная (растворимая) РНК Низкомолекулярная молекула РНК, выполняющая адапторные функции по специфическому переносу аминокислот к растущим полипептидным цепям в процессе трансляции; тРНК обладают характерной вторичной структурой в виде… …
ТРНК. См. растворимая РНК. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) …
тРНК - транспортная рибонуклеиновая кислота транспорт … Словарь сокращений и аббревиатур
Структура транспортной РНК Транспортная РНК, тРНК рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза … Википедия
Большой медицинский словарь
См. Рибонуклеиновая кислота транспортная … Медицинская энциклопедия
тРНК-нуклеотидилтрансфераза - Фермент, осуществляющий присоединение триплета ЦЦА к 3 концам тРНК II типа (т.е. тРНК, предшественники которых лишены этого триплета часть тРНК прокариот и, видимо, все тРНК эукариот). [Арефьев В.А., Лисовенко Л.А. Англо русский толковый словарь… … Справочник технического переводчика
тРНК-подобный участок - * тРНК падобны ўчастак * tRNA like segment концевой участок нуклеиновой кислоты некоторых РНК содержащих вирусов, способный аминоацилироваться и взаимодействовать с некоторыми специфическими ферментами. В отличие от типичной тРНК, в составе тРНК… … Генетика. Энциклопедический словарь
тРНК-подобный участок - Концевой участок нуклеиновой кислоты некоторых РНК содержащих вирусов, способный аминоацилироваться аминокислотой и взаимодействовать с некоторыми специфическими ферментами; в отличие от тРНК в составе тРНК п.у. не найдено редких оснований,… … Справочник технического переводчика
TRNA nucleotidyl transferase тРНК нуклеотидилтрансфераза. Фермент, осуществляющий присоединение триплета ЦЦА к 3 концам тРНК II типа (т.е. тРНК, предшественники которых лишены этого триплета часть тРНК прокариот и, видимо, все тРНК эукариот).… … Молекулярная биология и генетика. Толковый словарь.
Книги
- Физика скрытых параметров: , И. Богданов. В работе устранены противоречия, мешающие получению признания физики скрытых параметров, созданной на основе теории электрических полей вращений. Найдено доказательство постулатов Бора,…