Ароматические углеводороды - это циклические, сопряженные соединения, которые благодаря своему строению проявляют особые физико-химические свойства. Позже к понятию "ароматические углеводороды" было отнесено их специфические физико-химические свойства:
- Склонность преимущественно к реакциям замещения;
- Устойчивость к воздействию окислителей и высоких температур.
Простейшим представителем аренов является бензол и его гомологи, конденсированные бензоидные, небензоидные и гетероциклические соединения.
Ароматичность представляется особой стабилизацией делокализованных циклических $\pi$-систем, содержащих ($4n + 2$) $\pi$-электронов. Этой «особой стабилизации» не наблюдается в случае ($4n$) $\pi$ циклических систем. Для малых циклов такая система будет дестабилизированной, т.е. такие системы будут «антиароматическими». Однако утверждение об особой стабилизации требует не только теоретических выкладок, но и определенных экспериментальных подтверждений. В связи с этим вопрос о выборе надежных экспериментальных критериев ароматичности приобретает принципиальную важность.
Признаки ароматичности
Ароматический характер углеводородов обусловлен как легкостью образования ароматических циклов, так и особенностью их физических и химических свойств.
Характерные свойства ароматических соединений (аренов) определяются своеобразностью их строения и обусловливают химический критерий ароматичности:
Физико-химические критерии ароматичности
Основным критерием ароматичности является соответствии молекулы основным требованиям:
- Молекула должна быть циклической и плоской;
- Молекула должна иметь замкнутую цепь сопряжения $\pi$-электронов;
- Количество $\pi$-электронов ($N$) в цепи сопряжение должно соответствовать правилу Хюккеля: $N = 4n + 2$, где $n = 0,1,2,3$ ...
Поэтому энергия сопряжение является главным критерием ароматичности.
Если соединение соответствует всем критериям ароматичности, то энергия сопряжение в молекулах достигает максимального значения, а сама соединение в результате этого становится чрезвычайно стабильной. Поэтому энергия сопряжение является главным критерием ароматичности.
Согласно определению IUРАС, ароматичность можно охарактеризовать как «понятие пространственной и электронной структуры циклических молекулярных систем, отражает эффекты циклической делокализации электронов, которые обеспечивают повышенную термодинамическую стабильность этих систем (по сравнению с ациклическими структурными аналогами) и тенденцию к сохранению структурного типа в ходе химических преобразований... ». Говоря о стабилизации циклических структур по сравнению с «ациклическими аналогами» ароматичность появляется как энергетически топологическое понятие, которое можно примерно оценить по физико-химическим наблюдениями. «Ациклические аналоги» на самом деле могут быть даже несуществующими химическими соединениями, а «плодом воображения с топологическими пределами».
Критерии оценки ароматичности
Критерии оценки ароматичности могут быть разделены на две категории в зависимости от контекста наблюдения - статические (изолированные молекулы) и динамические (молекула подвергается воздействию внешнего магнитного поля). Энергетические критерии (энтальпия реакций) и структурные (изменение длин связей) обуславливают принципиально различные магнитные критерии (ЯМР, изменения магнитной чувствительности) (Таблица 1).
Рисунок 4. Классификация критериев ароматичности
Структурная и энергетическая ароматичность
«Структурную» ароматичность можно оценить по средним длинами связей и отклонениями от этого среднего значения.
«Энергетическая» ароматичность может быть оценена через энтальпии реакций с раскрытием цикла. Резонансные энергии ($RE$), такие как резонансная энергия Бреслоу ($BRE$), рассчитываются по методу Хюккеля, в то время как для расчета энергий ароматической стабилизации ($ASE$) используют неэмпирические методы (ah initio).
Магнитная ароматичность
«Магнитная» ароматичность, обычно определяется количественно с помощью ЯМР, дезекрануванням ядер и независимого химического сдвига центра цикла (NICS «Nucleus Independent Chemical Schift»), как было предложено Шлейером в 1996г.
Понятия «ароматичность» и «антиароматичность» в химии не имеют отношения к наличию запаха у вещества. Ароматические соединения - это вещества, в которых замкнутая сопряженная система из π-электронов, образующаяся в результате перекрывания р-электронных облаков соседних атомов, придает молекуле аномально высокую стабильность. Самое, пожалуй, известное ароматическое соединение - бензол С 6 Н 6 , гораздо более инертный по сравнению с соединениями, в которых на углерод приходится большее число атомов водорода - С 6 Н 8 , С 6 Н 10 , С 6 Н 12 и С 6 Н 14 . В антиароматических соединениях замкнутая сопряженная система из π-электронов, напротив, делает антиароматическую молекулу крайне неустойчивой, а в ряде случаев антиароматические соединения с желаемой формулой вообще невозможно получить.
На основании свойств бензола и представлениях о том, что углерод образует четыре химические связи, а также о том, что атомы углерода способны связываться друг с другом двойными и тройными связями, было предложено несколько ошибочных вариантов структурных формул для бензола. Уже в ХХ веке все соединения, соответствующие этим формулам, были синтезированы. Было установлено, что их физические и химические свойства отличаются от свойств бензола. Также было обнаружено, что призман (бензол Ладенбурга) и бензол Дьюара самопроизвольно превращаются в бензол при комнатной температуре.

Правильную - циклическую - формулу этого соединения удалось установить Фридриху Августу Кекуле , который, судя по его воспоминаниям, пришел к этой идее во сне: ему приснилась змея, кусающая себя за хвост, и он решил, что бензол должен представлять собой шестичленный цикл из атомов углерода с чередующимися двойными и одинарными связями.
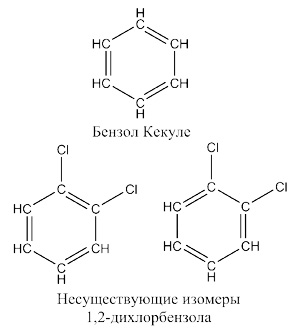
Правда, в соответствии с формулой Кекуле - и он сам так предполагал, - должно было бы существовать два изомера 1,2-дихлорбензола - в одном атомы хлора должны были быть разделены двойной связью, в другом - одинарной. Поскольку, как оказалось позже, в бензоле нет чередующихся двойных и одинарных связей, все атомы углерода эквивалентны, а π-электроны образуют единую замкнутую систему, такие изомеры и не могут существовать. Естественно, что их так и не удалось обнаружить, а сам Кекуле предполагал, что неудачи обнаружения этих изомеров связаны с очень быстрым превращению их друг в друга.
Именно Кекуле и ввел понятие «ароматичность», которое предложил рассматривать, как особую характеристику бензола и родственных по структуре соединений - их устойчивость и склонность участвовать в реакциях замещения, а не присоединения. Такое химическое поведение нельзя было объяснить формулой Кекуле, предполагавшей наличие в бензольном цикле трех двойных связей - в других соединениях, не относившихся к ароматическому ряду, кратные связи активно вступали в реакции присоединения.
В чем состоит причина такого поведения ароматических соединений удалось объяснить в 1931 году Эриху Хюккелю , который, использовав для изучения бензола упрощенный метод квантовой механики - метод молекулярных орбиталей , показал, что в молекуле бензола нет двойных и одинарных связей углерод–углерод, а р -электроны атомов углерода образуют единое кольцевое электронное облако, которому Хюккель дал название «ароматическая система». Он же разработал и фигурирующие в условии задачи правила, позволяющие относить молекулы к ароматическим или антиароматическим. Два правила Хюккеля одинаковы и для ароматических и для антиароматических соединений: плоское строение молекулы и замкнутая сопряженная система нужны для образования кольцевого электронного облака, а разное количество электронов в таком облаке может стабилизировать или дестабилизировать молекулу.
Хотя ароматичность - одна из важнейших концепций химии, пока нет общепринятого краткого определения этого понятия. Ароматичность понимается как совокупный набор особых признаков, в той или иной мере присущих ряду циклических сопряженных молекул. Часть этих признаков можно наблюдать экспериментально, но другие признаки можно описать, только основываясь на квантовой теории строения молекул (сюда как раз относится правило Хюккеля о числе электронов в замкнутой системе). Невозможно объяснить ароматичность с позиций только классической структурной теории химии.
Экспериментально наблюдать можно следующие проявления ароматичности:
1) Химическое - склонность ароматической молекулы к реакциям замещения , а не присоединения .
2) Структурный - тенденция к плоскому расположению атомов и выравниванию длин связей . У бензола выравнивание длин связей идеально - все шесть связей углерод-углерод одинаковы. У более сложных молекул выравнивание длин связей не идеально, но значительно.
3) Магнитный - замкнутая электронная система ароматических соединений оказывает влияние на параметры спектров ядерного магнитного резонанса ароматических соединений. В ароматических соединениях при приложении к ним внешнего магнитного поля возникает кольцевой ток, который способствует возникновению внутри молекул локального магнитного поля, направленного противоположно внешнему. В результате взаимодействия внутреннего и внешних магнитных полей экранирование атомов водорода и атомов углерода ароматической системы понижается, и их сигналы регистрируются в области слабых полей, которая обычно и называется «областью сигналов ароматических атомов водорода» для ЯМР-спектроскопии 1 Н и «областью сигналов ароматических атомов углерода» для ЯМР-спектроскопии 13 С.
Кроме бензольного кольца и углеводородов ароматические свойства проявляют многие гетероциклические соединения - пиррол , фуран , тиофен , пиридин , индол , оксазол и другие. При этом в сопряженную систему шестичленных гетероциклов гетероатом отдает один электрон (по аналогии с углеродом), в 5-атомных - неподеленную электронную пару. Ароматические свойства могут проявлять не только нейтральные молекулы, но и заряженные частицы, например, циклопропенилий-катион (2π-электронная система), циклопентадиенил-анион (6π-электронная система), циклогептатриенил-катион (6π-электронная система), циклооктатетраенил-дианион (10π-электронная система).

В ряде случаев ароматические соединения получают из неароматических веществ в ходе процесса ароматизации. Наибольшее практическое значение имеет каталитический риформинг бензиновых фракций, который увеличивает октановое число моторного топлива (см. послесловие к задаче
АРОМАТИЧНОСТЬ (от греч. aroma, род. падеж aromatos - благовоние), понятие, характеризующее совокупность структурных, энергетич. св-в и особенностей реакц. способности циклич. структур с системой сопряженных связей. Термин введен Ф. А. Кекуле (1865) для описания св-в соединений, структурно близких к бензолу - родоначальнику класса ароматических соединении .
К числу наиб. важных признаков ароматичности принадлежит склонность ароматич. соед. к замещению, сохраняющему систему сопряженных связей в цикле, а не к присоединению, разрушающему эту систему. Кроме бензола и его производных, такие р-ции характерны для полицикли ч. ароматич. углеводородов (напр., нафталина , антрацена , фенантрена и их производных), а также для изоэлектронных им сопряженных гетероциклич. соединений. Известно, однако, немало соед. (азулен , фульвен и др.), к-рые также легко вступают в р-ции замещения, но не обладают всеми др. признаками ароматичности.
Реакц. способность не может служить точной характеристикой ароматичности еще и потому, что она отражает св-ва не только осн. состояния данного соединения, но и переходного состояния (активиров. комплекса) р-ции, в к-рую это соед. вступает. Поэтому более строгие критерии ароматичности связаны с анализом физ. св-в осн. электронных состояний циклич. сопряженных структур. Главная трудность состоит в том, что ароматичность не является экспериментально определяемой характеристикой. Поэтому не существует однозначного критерия для установления степени ароматичности, т.е. степени подобия св-вам бензола . Ниже рассмотрены наиб. важные признаки ароматичности.
Строение электронной оболочки ароматических систем.
Тенденция бензола и его производных к сохранению структуры сопряженного кольца в разл. превращениях означает повыш. термодинамич. и кинетич. устойчивость этого структурного фрагмента. Стабилизация (понижение электронной энергии) молекулы или иона , обладающих циклич. структурой, достигается при полном заполнении электронами всех связывающих молекулярныхорбиталей и вакантности несвязывающих и антисвязывающих орбиталей . Выполнение этих условий достигается, когда общее числоэлектронов в циклич. полиене равно (4л + 2), где п = = 0,1,2... (правило Хюккеля).
Это правило объясняет устойчивость бензола (ф-ла I) и циклопентадиенильного
аниона (II; п = 1). Оно позволило правильно предсказать устойчивость
циклопропенильного (III; п = 0) и циклогептатриенильного (IV; п
= 1) катионов . Ввиду подобияэлектронных
оболочек соед. II-IV и бензола они, как и высшие циклич. полиены - ,
, аннулены (V-VII), рассматриваются как ароматич. системы.

Правило Хюккеля можно экстраполировать на ряд сопряженных гетероциклич.
соед. - производные пиридина (VIII) и катиона пирилия (IX), изоэлектронные
бензолу , пятичленные гетероциклы типа X (пиррол , фуран , тиофен), изоэлектронные
циклопентадиенильному аниону . Эти соединения также относят к ароматич.
системам.

Для производных соединений II-Х и др. более сложных структур, получаемых изоэлектронным замещением метиновых групп в полиенах I-VII, также характерны высокая термодинамич. устойчивость и общая склонность к р-циям замещения в ядре.
Циклич. сопряженные полиены , имеющие в цикле 4nэлектронов (n=1,2...), неустойчивы и легко вступают в р-ции присоединения, т. к. обладают незамкнутой электронной оболочкой с частично заполненными несвязывающими орбиталями . Такие соединения, наиб. типичным примером к-рых служит циклобутадиен (XI), относят кантиароматич. системам.
Правила, учитывающие числоэлектронов в цикле, полезны для характеристики св-в моноциклич. структур, однако неприложимы к полициклам. При оценке ароматичности последних необходимо учитывать, как соответствуют этим правилам электронные оболочки каждого отдельного цикла молекулы . С осторожностью следует пользоваться ими и в случае многозаряженных циклич. ионов . Так, электронные оболочки дикатиона и дианиона циклобутадиена отвечают требованиям правила Хюккеля. Однако эти структуры нельзя относить к ароматическим, т. к. дикатион (п = 0) устойчив не в плоской форме, обеспечивающей циклич. сопряжение, а в согнутой по диагонали; дианион (n=1) вообще неустойчив.
Энергетические критерии ароматичности. Энергия резонанса. Для определения количеств. меры ароматичности, характеризующей повыш. термодинамич. устойчивость ароматич. соед., было сформулировано понятие энергии резонанса (ЭР), или энергии делокализации.
Теплота гидрирования молекулы бензола , формально содержащей три двойные связи , на 151 кДж/моль больше, чем теплота гидрирования трех молекул этилена . Эту величину, связываемую с ЭР, можно рассматривать как энергию, дополнительно затрачиваемую на разрушение циклич. системы сопряженных двойных связей бензольного кольца, стабилизирующей эту структуру. Т. обр., ЭР характеризует вклад циклич. сопряжения в теплоту образования (полную энергию, теплоту атомизации) соединения.
Предложен ряд способов теоретич. оценок ЭР. Они различаются гл. обр.
выбором структуры сравнения (т.е. структуры, в к-рой нарушено циклич. сопряжение)
с циклич. формой. Обычный подход к вычислению ЭР состоит в сопоставленииэлектронных
энергийциклич.
структуры и суммы энергий всех изолированных кратных связей , содержащихся
в ней. Однако рассчитываемые т. обр. ЭР, независимо от используемого квантовохим.
метода, имеют тенденцию к возрастанию с увеличением размеровсистемы.
Это нередко противоречит эксперим. данным о св-вах ароматич. системы. Так,
ароматичность в ряду полиаценовбензол (I), нафталин (XII), антрацен (XIII), тетрацен
(XIV) понижается (напр., возрастает склонность к присоединению, увеличивается
альтернирование длин связей), а ЭР (приведены в единицах=
75 кДж/моль) растут:

Этого недостатка лишены величины ЭР, рассчитываемые путем сравненияэлектронных энергий циклич. структуры и аналогичного ациклич. сопряженного полнена (М. Дьюар, 1969). Рассчитанные т. обр. величины принято называть ЭР Дьюара (ЭРД). Напр., ЭРД бензола (1,013) вычисляется при сопоставлении его с 1,3,5-гексатриена, а ЭРД циклобутадиена-сопоставлением его= = с 1,3-бутадиена.
Соединения с положит. значениями ЭРД относят к ароматическим, с отрицательными-к
антиароматическим, а со значениями ЭРД, близкими к нулю, - к неароматическим.
Хотя значения ЭРД варьируют в зависимости от приближений квантовохим. метода
расчета, относит. порядок их практически не зависит от выбора метода. Ниже
приведены ЭРД в расчете на одинэлектрон
(ЭРД/е; в единицах),
вычисленные по модифициров. методу молекулярных орбиталей Хюккеля:

Наиб. ЭРД/е, то есть наиб. ароматичностью, обладает бензол . Понижение ЭРД/е отражает понижение ароматич. св-в. Приведенные данные хорошо согласуются со сложившимися представлениями о проявлениях ароматичности.
Магнитные критерии ароматичности. Циклич. сопряжениеэлектронов приводит к возникновению в молекуле кольцевого тока, к-рый вызывает экзальтацию диамагн. восприимчивости. Поскольку величины кольцевого тока и экзальтации отражают эффективность циклич. сопряжения, они м. б. использованы как количеств. мера ароматичности.
К ароматическим относятся соед., в молекулах к-рых поддерживаются наведенные диамагнитныеэлектронные кольцевые токи (диатропные системы). В случае аннуленов (n = 0,1,2...) существует прямая пропорциональность между силой кольцевого тока и величиной ЭРД. Однако для неальтернантных углеводородов (напр., азулена) и гетероциклич. соед. эта зависимость усложняется. В ряде случаев система м.б. одновременно и диатропной и антиароматической, напр. бициклодекапентаен.
Наличие индуциров. кольцевого тока в циклич. сопряженных системах характерно проявляется в спектрах протонного магн. резонанса (ПМР), т.к. ток создает анизотропное магн. поле, заметно влияющее на хим. сдвиги протонов , связанных с атомами кольца. Сигналы протонов , расположенных во внутр. части ароматич. кольца, смещаются в сторону сильного поля, а сигналы протонов , расположенных на периферии кольца, - в сторону слабого поля. Так, внутр. протоны аннулена (ф-ла VI) и аннулена (VII) проявляются при - 60°С в спектре ПМР соотв. при 0,0 и -2,99м. д., а внешние-при 7,6 и 9,28 м. д.
Для антиароматич. систем аннуленов, наоборот, характерны парамагн. кольцевые токи, приводящие к сдвигу внеш. протонов в сильное поле (паратропные системы). Так, хим. сдвиг внеш. протонов аннулена равен всего 4,8 м.д.
Структурные критерии ароматичности. Важнейшие структурные характеристики молекулы бензола - ее планарность и полная выравненность связей. Молекулу можно рассматривать как ароматическую, если длины углерод-углеродных связей в ней лежат в пределах 0,136-0,143 нм, т.е. близко к 0,1397 нм для молекулы бензола (I). Для нециклич. сопряженных полиеновых структур длины связей С-С составляют 0,144-0,148 нм, а связей С=С-0,134-0,135 нм. Еще большее альтернирование длин связей характерно для антиароматич. структур. Это подтверждается данными строгих неэмпирич. расчетов геометрич. параметров циклобутадиена и эксперим. данными для его производных.
Предложены разл. выражения для количеств. характеристики ароматичности по степени
альтернирования длин связей, напр. для углеводородов вводится индекс ароматичности
(НОМА d):
где а = 98,89, Х r - длина r-ной связи (в А), n-число связей. Для бензола HOMA d максимален и равен 1, для циклобутадиена минимален (0,863).
Ароматичность - понятие, характеризующее совокупность особых структурных, энергетических и магнитных свойств, а также особенностей реакционной способности циклических структур с системой сопряженных связей.
Хотя ароматичность - одна из важнейших и наиболее плодотворных концепций химии (не только органической), - не существует общепринятого краткого определения этого понятия. Ароматичность понимается через совокупность особых признаков (критериев), присущих ряду циклических сопряженных молекул в той или иной мере. Часть этих критериев имеет экспериментальную, наблюдаемую природу, но другая часть основывается на квантовой теории строения молекул. Ароматичность имеет квантовую природу.
Невозможно объяснить ароматичность с позиций классической структурной теории и теории резонанса.
Не следует путать ароматичность с делокализацией и сопряжением.
В молекулах полиенов (1,3-бутадиена, 1,3,5-гексатриена и т.п.) проявляется явно выраженная тенденция к делокализации электронов и образованию единой сопряженной электронной структуры, что проявляется в спектрах (в первую очередь, электронных спектрах поглощения), некотором изменении длин и порядков связей, энергетической стабилизации, особых химических свойствах (электрофильное 1,4-присоединение в случае диенов и пр.). Делокализация и сопряжение - необходимые, но не достаточные условия ароматичности. Можно дать определение ароматичности как свойства, при котором сопряженное кольцо ненасыщенных связей проявляет бόльшую стабильность, чем ту, которую можно было бы ожидать только при одном сопряжении. Однако этим определением нельзя пользоваться, не имея экспериментальных или расчётных данных по стабильности циклической сопряжённой молекулы.
Для того чтобы молекула могла быть ароматической, она должна содержать хотя бы один цикл, каждый из атомов которого располагает пригодной для образования ароматической системы р-орбиталью. Ароматическим в полном смысле этого слова считается (в случае выполнения критериев, перечисленных ниже) именно этот цикл (кольцо, система колец).
В этом цикле должно быть 4n+2
(то есть 2, 6, 10, 14, 18, 22 и т.п.) p-электронов
.
Это правило называется правилом или критерием ароматичности Хюккеля
. Источник этого правила - сильно упрощенные квантовохимические расчеты идеализированных циклических полиенов, произведенные на заре развития квантовой химии. Дальнейшие исследования показали, что в основе своей это простое правило дает верные предсказания ароматичности даже и для очень сложных реальных систем.
Правилом, тем не менее, нужно правильно пользоваться, иначе прогноз может быть неверен.
Какие орбитали считаются пригодными для образования ароматической системы? - Любые орбитали, перпендикулярные плоскости цикла, и
а) принадлежащие входящим в цикл кратным (эндоциклическим двойным или тройным) связям;
б) соответствующие неподеленным парам электронов у гетероатомов (азота, кислорода, и т.п.) или карбанионов;
в) соответствующие шестиэлектронным (секстетным) центрам, в частности карбокатионам.
Критерии ароматичности.
Энергетический
(повышение термодинамической устойчивости за счет делокализации электронов, так называемая энергия делокализации - ЭД).
Можно представить бензол производным трёх молекул этилена и сравнить энергии исходных фрагментов и конечной молекулы. У каждой молекулы этилена по 2 p-электрона (всего 6) на молекулярных орбиталях (МО) одинаковой энергии (α+β), а у бензола 6 электронов располагаются на трёх связывающих молекулярных орбиталях, давая в сумме более отрицательное значение энергии системы (α и β меньше 0).
Очевидное энергетическое преимущество составляет 2β = 36 ккал/моль или 1,56 эВ - это ЭЭР (эмпирическая энергия резонанса).
Энергетический критерий из всех самый неудобный и неясный. Величины энергий для этого критерия берут всегда расчетные, потому что, как правило, невозможно подобрать соответствующую неароматическую молекулу для сравнения. Следует, поэтому, спокойно относиться к тому, что существует множество различных оценок энергии делокализации даже для классических ароматических молекул, а для более сложных систем эти величины вообще отсутствуют. Никогда нельзя сравнивать разные ароматические системы по величине энергий делокализации - нельзя сделать вывод, что молекула А ароматичнее молекулы В, потому что энергия делокализации больше.
Структурный
- очень важный, если не самый важный, критерий, так как имеет не теоретическую, а экспериментальную природу. Специфика геометрии молекул ароматических соединений заключается в тенденции к копланарному расположению атомов и выравниванию длин связей. У бензола выравнивание длин связей идеально - все шесть С-С связей одинаковы по длине. У более сложных молекул выравнивание не идеально, но значительно. В качестве критерия берут меру относительного отклонения длин сопряженных связей от среднего значения. Чем ближе к нулю, тем лучше. Эту величину можно проанализировать всегда, если имеется структурная информация (экспериментальная или из высококачественного квантовохимического расчета). Тенденция к копланарности обуславливается выгодностью параллельного расположения осей атомных р-орбиталей для их эффективного перекрывания.
Магнитный
(наличие кольцевого тока - диатропная система, влияние на химические сдвиги протонов снаружи и внутри кольца, примеры - бензол и -аннулен). Самый удобный и доступный критерий, так как для его оценки достаточно спектра 1H ЯМР. Для точного определения используют теоретические расчеты химических сдвигов.
Химический
- склонность к реакциям замещения, а не присоединения. Самый наглядный критерий, ясно различающий химию ароматических соединений от химии полиенов. Но работает он далеко не всегда. В ионных системах (например, в циклопентадиенил-анионе или тропилий-катионе) замещение наблюдать невозможно. Реакции замещения иногда проходят и на неароматических системах, а ароматические всегда в какой-то степени способны к реакциям присоединения. Поэтому химический критерий более правильно назвать признаком ароматичности.
Представление энергии ароматической системы.
Общая формула:
E j (энергия орбитали j уровня) = α + m j β
α - кулоновский интеграл, энергия С2р орбитали,
β - резонансный интеграл, энергия взаимодействия 2-х атомных орбиталей на соседних атомах
m j = 2сos(2jπ/N), где N- число атомов углерода в цикле.
Наиболее простым и наглядным графическим изображением энергии являтся круг Фроста . Для его построения необходимо вписать в окружность ароматическую молекулу, направив вершиной вниз, тогда точки соприкосновения многоугольника и окружности будут соответствовать энергетическим уровням МО. По вертикали наносится энергетическая шкала, все уровни ниже горизонтального диаметра - связывающие, выше - разрыхляющие. Электроны заполняют от самой нижней орбитали согласно правилу Паули.

Наиболее выгодным будет такое состояние, когда полностью заполнены все связывающие орбитали.
Позднее появилось ещё множество предположений о структуре бензола:

Однако даже до сих пор молекула C 6 H 6 продолжает преподносить сюрпризы. Бодриков И.В.: «Я вынужден констатировать, что сейчас в мире нет человека, кто бы знал, что такое бензол» (2009)

(один из водородов перемещается в положение, перпендикулярное кольцу)
В органической химии хорошо известно и широко используется такое понятие, как ароматичность некоторых органических соединений. Термин «ароматичность» связан прежде всего с бензолом, его гомологами и многочисленными производными. Этот термин относится исключительно к структуре молекул этих веществ, их свойствам, но не имеет никакого отношения к их запаху. Правда, первые ароматические соединения имели, вероятно, приятный запах (некоторые натуральные эфиры, душистые смолы, например ладан и др.).
Ароматичность - общий признак некоторых циклических органических соединений, обладающих совокупностью особых свойств.
Наличие единой замкнутой системы π-электронов в молекуле - основной признак ароматичности.
Ароматические соединения подчиняются правилу Э. Хюккеля (1931):
Плоские моноциклические соединения, имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих электронов равно 4 n +2 (где n = 0,1,2,3, 4 и т.д., т.е. число π-электронов в молекуле может быть 2, 6, 10, 14, 18 и т.д.).
Эти особенности обусловливают все важнейшие физические и химические свойства ароматических соединений. Например, они вступают преимущественно в реакции замещения (в основном электрофильного), а не присоединения (несмотря на формальную ненасыщенность). Ароматические соединения обладают высокой устойчивостью, например к окислителям. Их молекулы имеют плоское строение. Если же это требование не выполняется, то в молекуле нарушается параллельность осей 2р-орбиталей, что приводит к устранению сопряжения и, как следствие, к нарушению выравненности π-электронной плотности в системе.
Номенклатура
Систематическое название всех ароматических углеводородов - арены , а бензола - бензен . Гомологи бензола рассматривают как замещенные бензола и цифрами указывают положение заместителей. Однако систематическая номенклатура допускает название «бензол», а для некоторых гомологов бензола - тривиальные названия: винилбензол (I) называют стиролом , метилбензол (II) - толуолом, диметилбензол (III) - ксилолом, изопропилбензол (IV) - кумолом, метоксибензол (V) - анизолом и т.д.:
Ароматические радикалы имеют общее название - арилы (Аr). Радикал С 6 Н 5 - называют фенилом (от старого названия бензола - «фен»).
Изомерия.
Общая формула гомологов бензола С n Н 2 n -6 . Все шесть атомов водорода в молекуле бензола одинаковы и при замещении одного из них на один и тот же радикал образуется одно и то же соединение. Поэтому однозамещенный бензол изомеров не имеет. Например, существует только один метилбензол:

При замещении двух атомов водорода на метальные группы образуются три изомера - ксилолы , которые отличаются друг от друга расположением заместителей в кольце:



орто -диметилбензол, мета -диметилбензол, пара -диметилбензол,
или 1,2-диметилбензол или 1,3-диметилбензол или 1,4-диметилбензол
(о -ксилол) (м -ксилол) (п -ксилол)
Вместо буквенного обозначения (орто-, мета-, пара -, или сокращенно: о-,м-, п-) можно пользоваться цифровым: 1,2-, 1,3-, 1,4-. Изомеры могут отличаться характером заместителей:


пропилбензол изопропилбензол